凝固点降下(定義・公式・計算問題の解き方など)


物質量を方程式にしているので、 2段階の計算していること以外は方針としては今までと同じで間違いではありません。 例えば、砂糖の濃厚水溶液に純水を加えてかき混ぜると、砂糖の希薄溶液ができますが、得られた希薄溶液をいくらかき混ぜても、元の濃厚水溶液には戻りません。
11

物質量を方程式にしているので、 2段階の計算していること以外は方針としては今までと同じで間違いではありません。 例えば、砂糖の濃厚水溶液に純水を加えてかき混ぜると、砂糖の希薄溶液ができますが、得られた希薄溶液をいくらかき混ぜても、元の濃厚水溶液には戻りません。
11食塩はほぼ完全に電離するが、例えば酢酸など中途半端に電離する溶質は計算が難しくなる。
このグラフの左右を入れ替える。 ブドウ糖による凝固点降下度は 0. 古典的にはこの性質を使い導出されるよりを決定した時代があったが、今日においては一般的ではない。 冬に橋のたもとや峠においてあります。
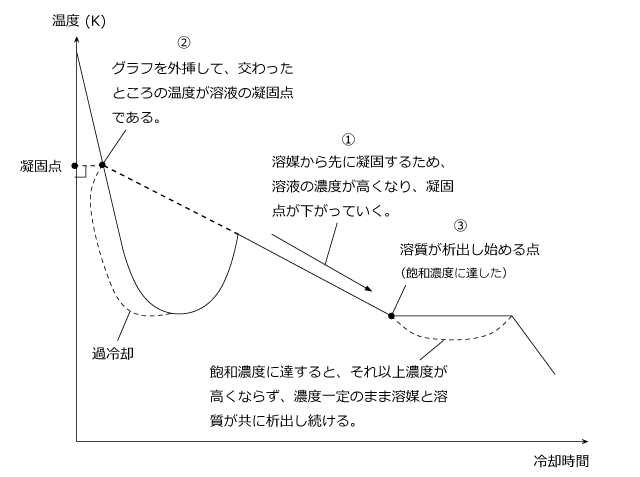
11実は、 溶液が凍り始める時には溶媒分子から凝固していきます! つまり、溶媒分子のみの場合に対して溶質が混ざった溶液は凝固しようとする溶媒分子数が少ないので、<図5> さらに温度が下がらないと凝固する分子=融解する分子になりません。


しかし、これが水溶液になると、溶質粒子の影響があるので、氷の水分子よりも水溶液中の水分子の方が安定になります。 温度を下げようと周囲から冷却をしても、すぐに凝固熱が生じて温度が上昇します。 もう一度、純溶媒のみの凝固点の様子をみてみましょう。
1590g溶かした。
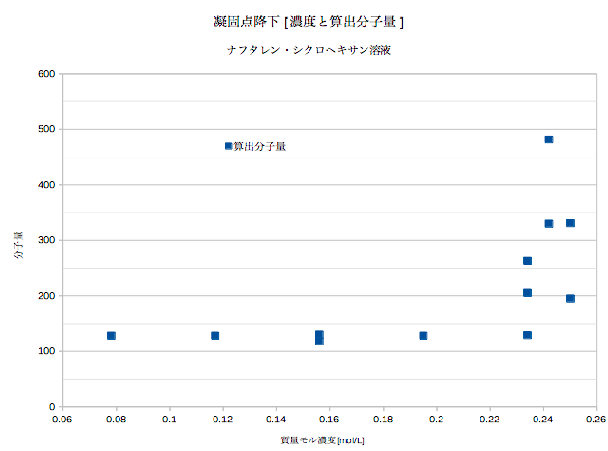
そして、この希薄溶液のときだけこの法則が成り立つ、つまり、 ほんの少ししか溶かさないということが、モル濃度ではなく、質量モル濃度を使う理由になるのです。 しかし、 分子量が大きくなると沸点上昇度や凝固点降下度の値は小さくなるので測定が難しくなります。
かっこよく見えるだけで答えは同じですからね。

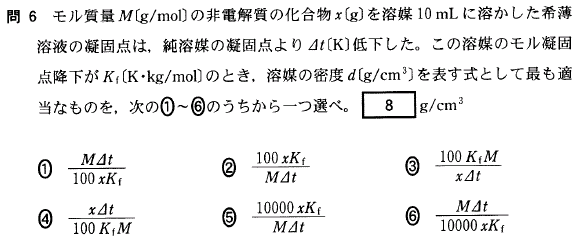
11g溶かした。 この章の学習内容は,次の通りです。 それは凝固点降下という現象のせいです。
溶媒しかないので、凝固を邪魔するもの(=阻害するもの)がありません。 図 1. 水にブドウ糖などの溶質を溶解させると次のようになる。