モル濃度

式であり、+½乗に物理的な意味はない。+→+式の上では+x+は無次元数.jpg)
(大きく変わると困ります。 例えば、ここに食塩を水に溶かした食塩水があるとします。 大まかな計算の手順 では本題、 濃度の変換の方法についてまとめてみます。
18また、 水蒸気の計算でも同じ計算です。 そこには,水酸化ナトリウムが2mol含まれていることになります。


絶対に溶液に使わないでください。 しっかりと覚えておきましょう。
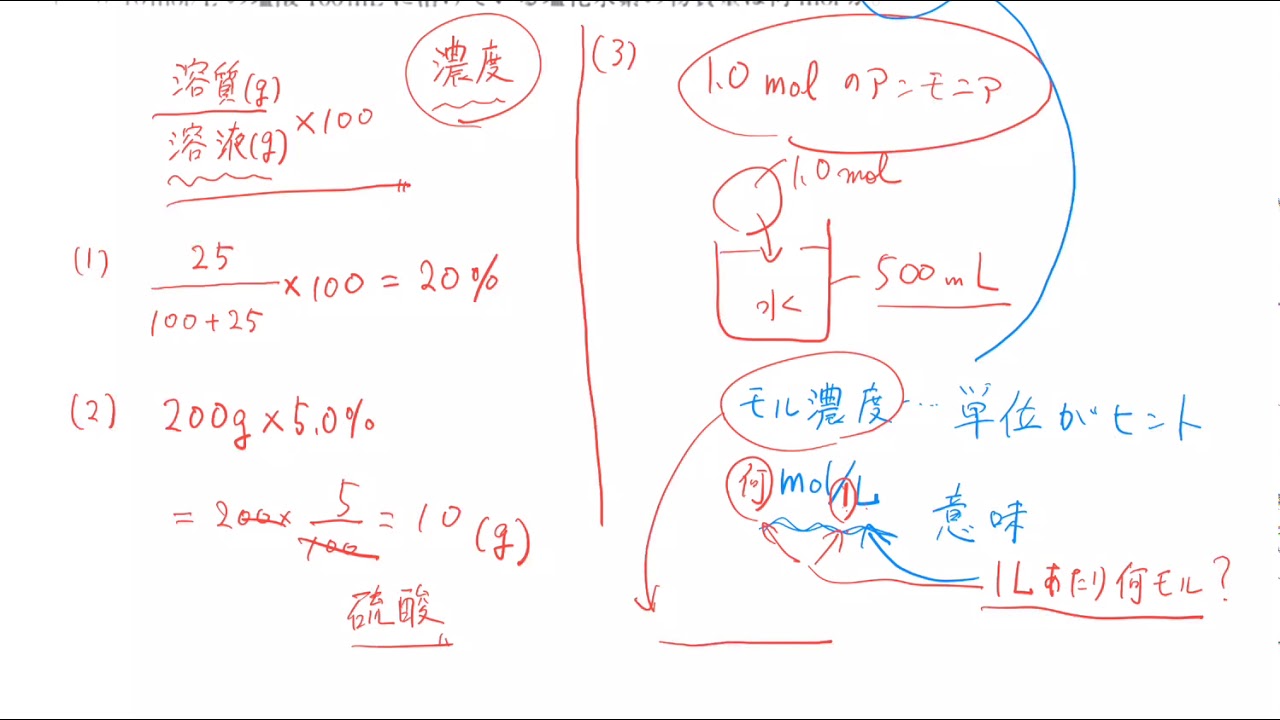
物質量は、文字通り物質の量です。 では、小中学校で一番最初に学習する濃度である、質量パーセント濃度から解説していきましょう。

この水酸化ナトリウム水溶液が1Lあるとします。 15%の食塩水 100gの場合、 食塩は15g、水は85gということになります。
この解説で述べたことをしっかり覚えておいて,計算問題をいくつか解いて慣れておきましょう。 高校化学では頻出の問題なので、できるようにしておきましょう! 4:【応用】モル濃度と質量パーセントを使った計算問題 最後に、モル濃度と質量パーセントを使った計算問題を用意しました。


気を付けたいのは、溶液の体積は問題になりますが、溶液の質量を考えなくて構わないということです。 NaOHの分子量が40ということは、NaOHを1mol集めれば40gになるということです。 #4 >水が沸騰しても同じ体積の中に閉じ込められていると、体積が3桁増になりたいのに「我慢」をさせられるわけです。
20重要なのは 分母が「 溶液の質量」ではなく、 「溶媒の質量」であると言う事です。

そこには何molの水酸化ナトリウムが含まれていますか? あとはモル濃度からの質量パーセントの求め方ですね。
STEP5:【溶媒1Kgあたりに変換して完了!】 0. モル分率は、含まれている全ての成分の合計物質量に対する、ある成分が占める物質量の割合のことです。 分子量の値はオレイン酸282、オクタン114です。
だから沸騰がおこらないのです。
モル濃度では、溶液の体積[L]だったのに対し、 質量モル濃度では溶媒の質量[kg]です。 つまり、 溶質の重量が全体の重量に対して どのくらいあるかを百分率で表した数値です。