中和滴定の考察がわかりません。
水溶液から沈殿で作るときには温度によって結晶水の異なるものが取れます。 この希硫酸の濃度 は、次のように求めることができます。
41 回目 2 回目 3 回目 4 回目 滴定前の液量 V 1 mL 6. ———————————————— こんにちは、受験メモ管理人、 東大卒塾講師の山本です。
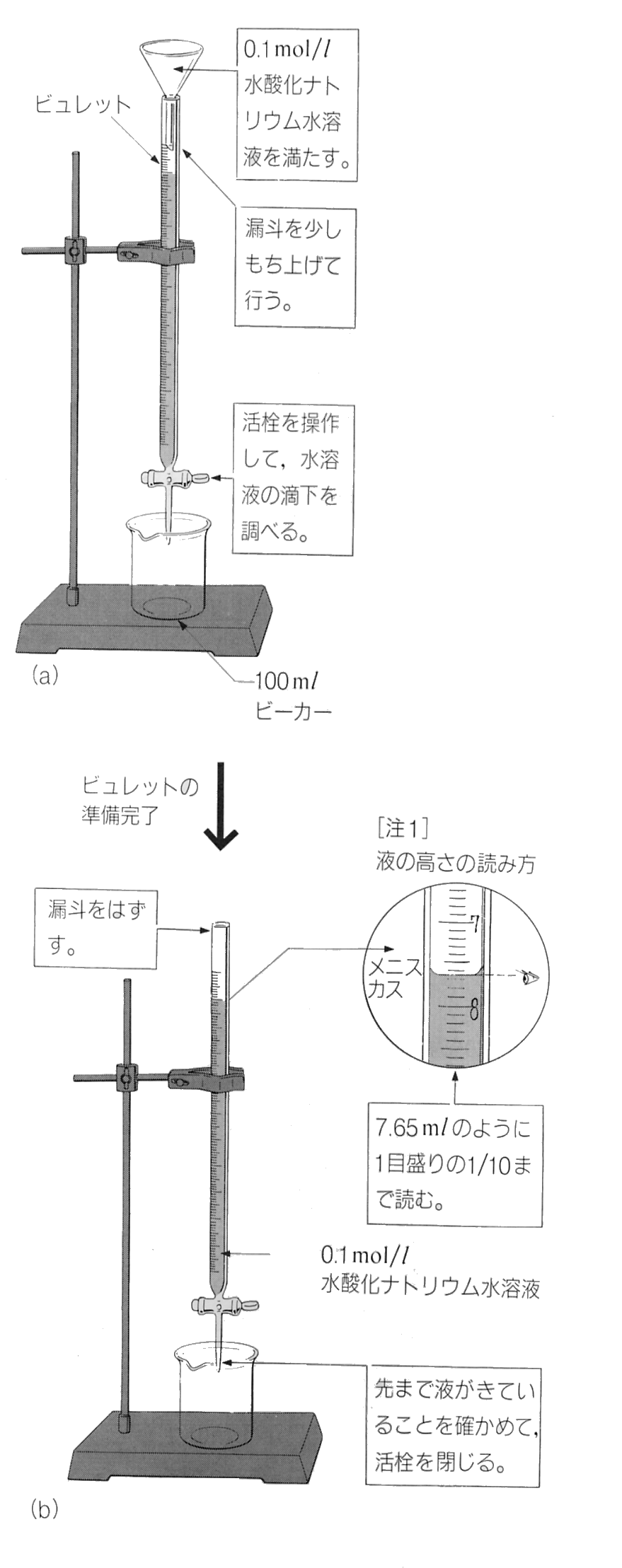
そのため、実験は慎重かつ正確に行われる必要があります を参照。 はじめに、ビュレットに入っている水酸化ナトリウム水溶液の目盛りを確認しておきます。

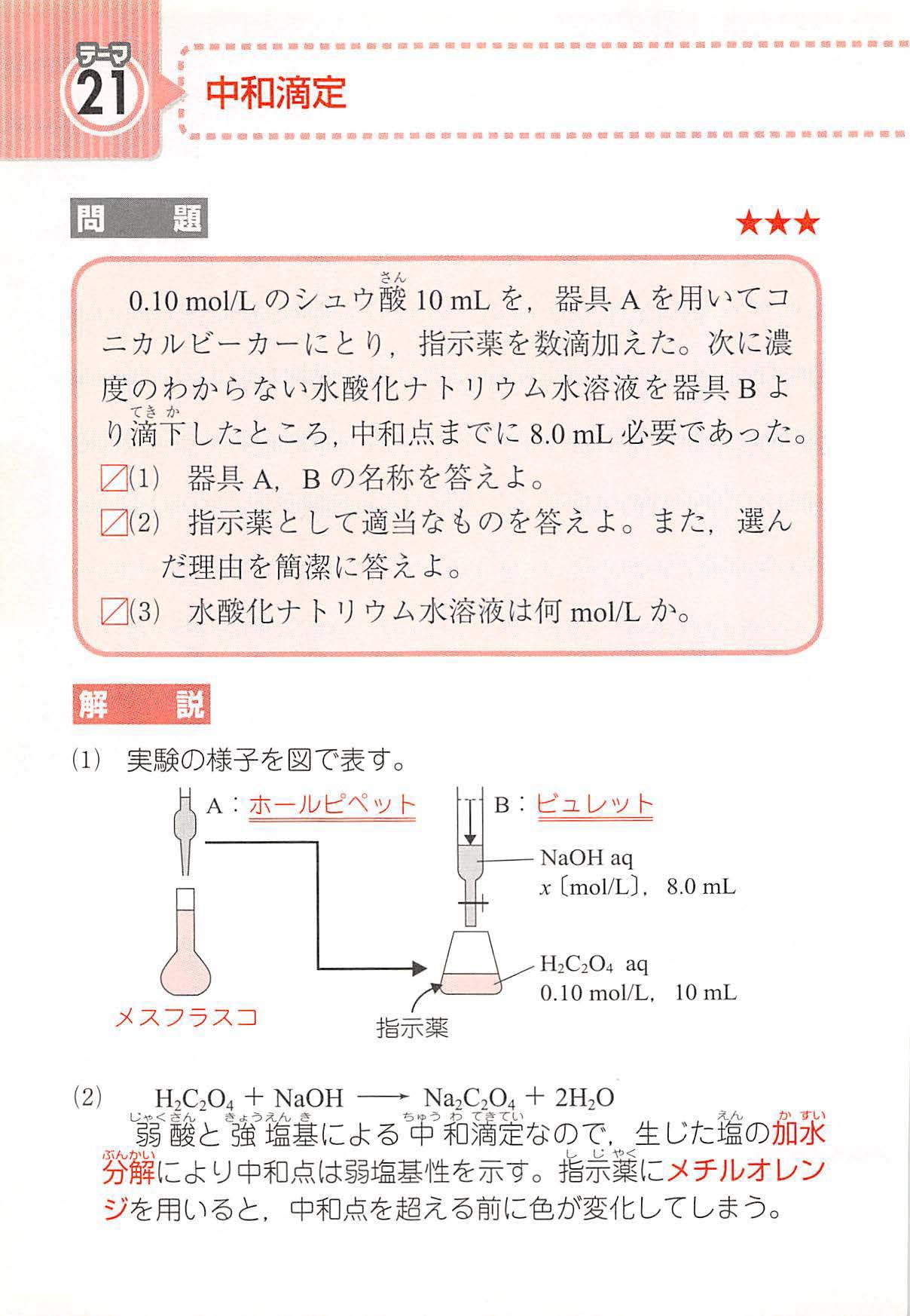
水で濡れていてもよい器具はメスフラスコとコニカルビーカーです。 その為です。
色素を溶かした溶媒が残っていると,展開の仕方が変わってしまいます。 原理の説明や文献の引用を絡めながらの考察などは、本格的な論文などの中でも簡潔な形で記述されていますので、私個人としては良いことであると思っています。
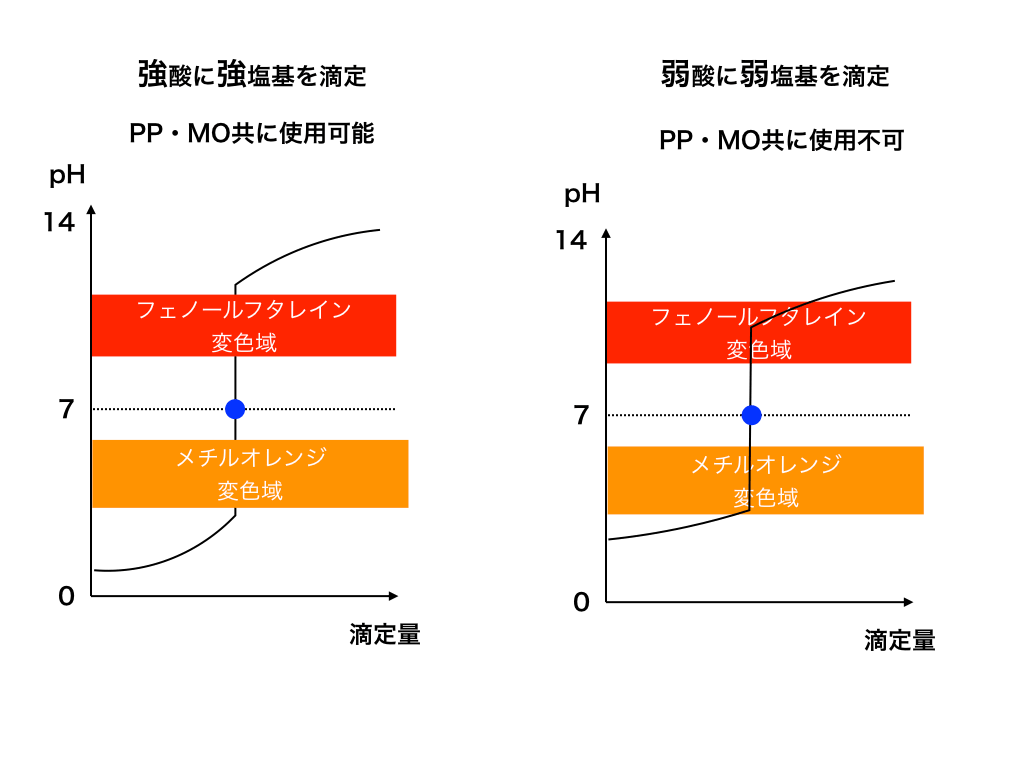
その際は、O,1. 端まで展開してしまうと正確な Rf 値が求められませんので,上部1センチ程残します。 1 ビュレットから水酸化ナトリウム水溶液を滴下していき、フェノールフタレインの赤色が消えなくなったときが終点である 2 理論 中和反応を利用して、濃度未知の水溶液の濃度を求める操作を、「中和滴 定 neutralization titration 」と いいます。

検量線から推定して1. これを使うと二段滴定が混ざってきて問題を難しくすることが出来るからです!では、まずはこの記事では、アンモニアと二酸化炭素の逆滴定を見ていきましょう! アンモニアの逆滴定 アンモニアを中和滴定で定量したい、じゃあ、アンモニアを水に溶かそう!と思いますが、冒頭でも話しました。
10中略 結果 (シュウ酸の濃度の求め方、滴定した回数分の滴定量、平均滴定量、濃度の計算など示します) 考察 水酸化ナトリウムの濃度は、1.01Mであった。 0mlを要した。
器具も何を使うか書いてませんが、メスピペットなどではかり取る液の量の誤差や、ビュレットの目盛りの読み取り誤差。 6、混合物の中和 (1) 0. NaOHやHClのような1価のものは、モル濃度と同じです。 問3 うすめる前の酢酸水溶液のモル濃度を、有効数字2桁で答えよ。
7測定の際の各液の体積の測定誤差。 実験結果が、実際の値と等しくなるとは限らないということに、留意しなければなりません。


だから、 難溶性の酸塩基とか、気体とかでこの回りくどい逆滴定ってやつをやらないといけないのです。 このワインだって同じだ。
興味があれば,それらも御覧になって見て下さい。 A シュウ酸二水和物W[g]をはかり取り、水に溶かして正確に500mlの溶液にした。