5分でわかる「酸化数」何を数値にしたもの?求め方は?酸化・還元とは?元研究員がわかりやすく解説
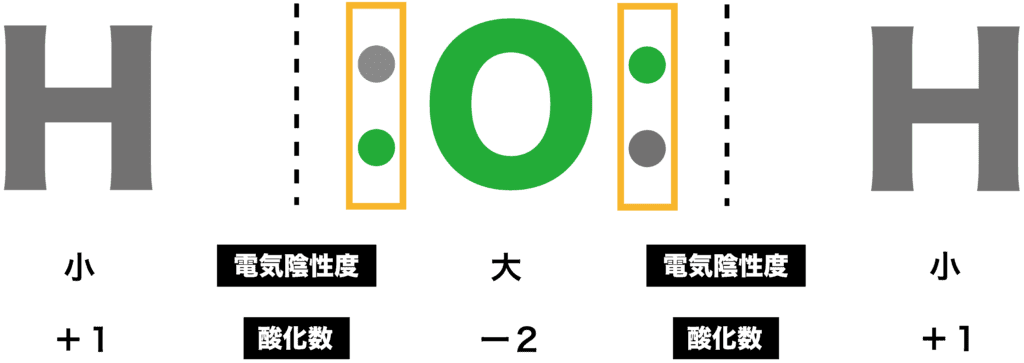
電気的に中性の化合物においては、構成物質の酸化数の総和は0である。
2共有結合の結晶は特徴と例を覚えておけば大丈夫ですよ。 したがって、 酸化されやすい物質ほど強い還元剤となります。


2018. 多原子イオンの酸化数 多原子イオンの酸化数については単原子イオンの酸化数と同様の考え方をすればいい。 O4でまとめて酸化数を-8としてはいけません。 わかりやすいように線を引いて、共有電子対がOに所属していることを明示しましょう。
1電子のやり取り 電子を中心に見た場合の酸化と還元の関係を解説します。 酸化数 酸化と還元について、酸素の授受はわかりやすいですが、水素・電子の授受はわかりにくいですね。
まず、金属に配位しているをまず中性配位子とアニオン性配位子に分類する。

なんとなく溶液の分野というだけで、 苦手意識を持っている人が多いのではないでしょうか。
「酸化数に関する定義」については2で解説します。 代表的な手法としてはのポピュレーション解析 population analysis と呼ばれる手法がある。
7番目のルールからLiHの酸化数の総和は0であり、Hの酸化数は-1である。

・酸化数が変化している化合物・単体・イオンが 1つでもあれば、それは酸化還元反応です。 水素、リチウム、ナトリウム、カリウムなどの1族は通常1+にしかなれません。
酸化は 《水素を放出すること》です。 これも原子の根本から考えて、フッ素、塩素、臭素などの17族は最外殻電子が1つ不足している状態で、電子を1つ受け入れれば最外殻電子が8つになりオクテット則を満たすので、酸化数は通常-1にしかなりません。

水素原子の酸化数は1とする(金属水素化物を除く)• ブログでは伝えきれない、 勉強の成果をきっちりと挙げる方法や、 受験勉強の考え方などをお伝えしようと思っています。 加える量としては左辺、もしくは右辺にある水素イオンがなくなる分を加えます。
11独自のDNA又はRNAを持っているが、普通ウイルスは細胞内だけで増殖可能であり、ウイルス単独では増殖出来ない。


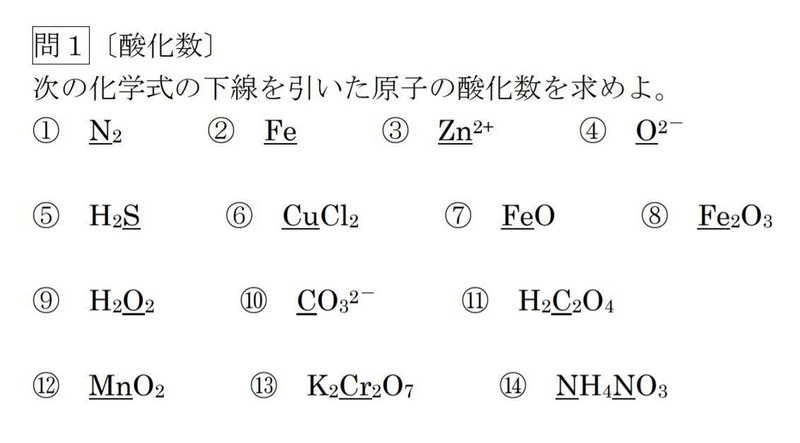
多原子イオンの酸化数 複数の原子で構成されている 多原子イオンも、その価数=酸化数となります。 解けないという事は、その単元が理解できていないという事ですから、かならず元に帰って理解すること。
化合物の成り立ち、化学結合のところで出てきたはずです。 そのため、 酸化数は+1となります。